BAB 2
STRUKTUR ATOM
A. Teori Tentang Atom
1. Democritus (500 SM)
Filsuf dari Yunani ini percaya bahwa semua materi (zat) tersusun dari partikel yang sangat kecil dan tidak dapat dibagi lagi yang disebut dengan atomos (tidak dapat dibagi)
2. John Dalton (1766 - 1844)
Seorang guru juga ilmuwan Inggris ini mendefinisikan bahwa benda terkecil penyusun materi yang tidak dapat dibagi lagi sebagai "atom". Ia membuat hipotesis yang menjadi dasar berkembangnya kimia modern. Berikut hipotesis yang telah dibuatnya :
- Unsur tersusun atas partikel yang sangat kecil dan tidak dapat dibagi lagi yang disebut dengan atom
- Atom-atom yang menyusun suatu unsur adalah identik, baik massa, ukuran dan sifatnya sama. Sedangkan atom dari unsur yang berbeda mempunyai massa, ukuran dan sifat yang beda
- Senyawa tersusun dari atom-atom yang terdiri dari dua unsur atau lebih dengan perbandingan tetap dan tertentu
- Atom tidak dapat diciptakan dan dimusnahkan.
B. Struktur Atom
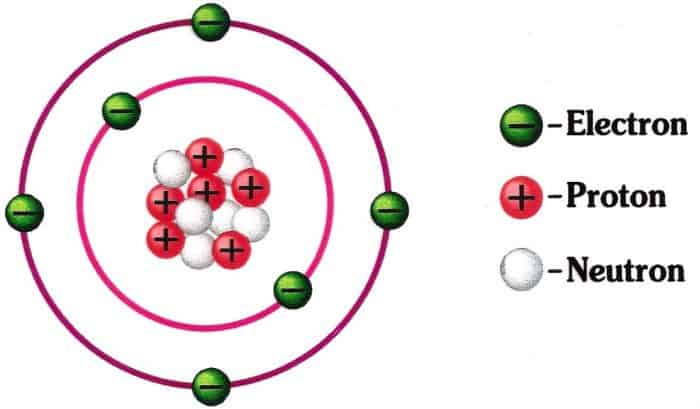
Sampai sekarang tak ada alat yang mampu untuk melihat bagaimana bentuk dan susunan atom. Penyelidikan dilakukan dengan mengamati fenomena yang ditimbulkannya. Setelah diamati ternyata atom mempunyai sifat listrik. Atom tersusun dari partikel-partikel penyusun yang terdiri dari Elektron, Proton dan Neutron.
- Elektron
Bermula dengan ditemukannya tabung sinar katode oleh Karl Ferdinand Braun. Ia mengamati aliran radiasi dari kutub negatif (katode) menuju kutub positif (anode) yang disebut sinar katode. Sifat sinar katode ini disempurnakan oleh Sir William Crookes.
Kemudian penelitian sinar katode disempurnakan oleh Joseph John Thomson. J.J Thomson menemukan muatan elektron yaitu sebesar 1,76 x 1018 coulomb/gram.
Penyelidikan lebih lanjut dilakukan Robert A.Milikan dengan percobaan tetes minyak.
Milikan menyebutkan bahwa muatan 1 elektron adalah 1,6022 x 10-19 C
J.J Thomson kemudian menyebutkan atom merupakan bola pejal yang bermuatan positif dan di dalamnya tersebar muatan negatif elektron. Teori ini dikenal dengan teori roti kismis. - Inti Atom dan Proton
Tahun 1886, Eugene Goldstein memodifikasi tabung sinar katode dengan melubangi lempeng katodenya. Ia menemukan sinar yang menembus lubang katodenya yang disebut sinar kanal.
Selanjutnya, Wilhelm Wien menyebutkan bahwa sinar kanal tersebut disebut proton.
Untuk mengetahui kedudukan partikel-partikel tersebut, Ernest Rutherford melakukan percobaan dengan hamburan sinar alfa terhadap lempeng tipis emas. Rutherford menyimpulkan bahwa atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif.
- Neutron
Tahun 1932, James Chadwick menemukan kejanggalan pada penelitian Rutherford. Penelitiannya menunjukkan kesalahan pada perbandingan massa atom hidrogen dan massa atom helium. Chadwick melakukan percobaan hamburan partikel alfa terhadap boron dan parafin . Apabila partikel alfa ditembakkan pada lapisan logam boron, ternyata logam tersebut memancarkan sinar yang serupa dengan gelombang elektromagnetik berenergi tinggi. Sinar tersebut tidak dibelokkan oleh medan listrik maupun medan magnet. Percobaan selanjutnya menunjukkan bahwa sinar tersebut merupakan partikel netral yang mempunyai massa sedikit lebih besar daripada massa proton. Partikel ini diberi nama neutron
C. Tanda Atom
Nomor Atom (Z), adalah jumlah proton terdapat dalam inti atom
Nomor Massa (A), adalah jumlah proton dan neutron.
secara umum :
A = nomor massa
Nomor Massa (A), adalah jumlah proton dan neutron.
secara umum :
A = nomor massa
= jumlah proton ( p ) + jumlah neutron ( n )
A = p + n = Z + n
1). ISOTOP
Adalah atom-atom dari unsur yang sama (mempunyai nomor atom yang sama) tetapi berbeda nomor massanya.
2). ISOBAR
Adalah atom-atom dari unsur yang berbeda (mempunyai nomor atom berbeda) tetapi mempunyai nomor massa yang sama.
3). ISOTON
Adalah atom-atom dari unsur yang berbeda (mempunyai nomor atom berbeda) tetapi mempunyai jumlah neutron yang sama.
D. Perkembangan Teori Atom
1). Model Atom Dalton
a) Atom digambarkan sebagai bola pejal yang sangat kecil.
b) Atom merupakan partikel terkecil yang tidak dapat dipecah lagi.
c) Atom suatu unsur sama memiliki sifat yang sama
d) Senyawa terbentuk jika atom bergabung satu sama lain.
e) Reaksi kimia hanyalah reorganisasi dari atom-atom
2). Model Atom Thomson
Setelah ditemukannya elektron oleh J.J Thomson, disusunlah model atom Thomson yang merupakan penyempurnaan dari model atom Dalton. Menurut Thomson :
a) Atom terdiri dari materi bermuatan positif dan di dalamnya tersebar elektron (bagaikan kismis dalam roti kismis)
b) Atom bersifat netral, yaitu muatan positif dan muatan negatif jumlahnya sama
3). Model Atom Rutherford
a) Rutherford menemukan bukti bahwa dalam atom terdapat inti atom yang bermuatan positif, berukuran lebih kecil daripada ukuran atom tetapi massa atom hampir seluruhnya berasal dari massa intinya.
b) Atom terdiri dari inti atom yang bermuatan positif dan berada pada pusat atom serta elektron bergerak melintasi inti (seperti planet dalam tata surya).
c) Atom bersifat netral.
d) Jari-jari inti atom dan jari-jari atom sudah dapat ditentukan.
4). Model Atom Niels Bohr
· Model atomnya didasarkan pada teori kuantum untuk menjelaskan spektrum gas hidrogen.
· Menurut Bohr, spektrum garis menunjukkan bahwa elektron hanya menempati tingkat-tingkat energi tertentu dalam atom.
Menurutnya :
a) Atom terdiri dari inti yang bermuatan positif dan di sekitarnya beredar elektron-elektron yang bermuatan negatif.
b) Elektron beredar mengelilingi inti atom pada orbit tertentu dengan gerakan stasioner (tetap), selanjutnya disebut dengan tingkat energi utama (kulit elektron) yang dinyatakan dengan bilangan kuantum utama (n).
c) Selama elektron berada dalam lintasan stasioner, energinya akan tetap
d) Elektron hanya dapat berpindah dari lintasan stasioner yang lebih rendah ke lintasan stasioner yang lebih tinggi jika menyerap energi. Sebaliknya, jika elektron berpindah dari lintasan stasioner yang lebih tinggi ke rendah terjadi pelepasan energi.
- Elektron-elektron yang mengelilingi inti pada lintasan-lintasan tertentu yang disebut dengan kulit elektron atau tingkat energi.
- Elektron menempati mulai dari kulit pertama K (dekat atom), kulit kedua disebut L, kulit ketiga disebut M, dan seterusnya.
- Tiap tiap kulit elektron hanya dapat ditempati oleh maksimum 2n2, dengan n adalah nomor kulit
- Jumlah elektron yang menempati kulit terluar disebut elektron valensi. Contoh elektron valensi K adalah 1, elektron valensi P adalah 5

5). Model Atom Modern ( Mekanika Kuantum )
Dikembangkan berdasarkan teori mekanika kuantum yang disebut mekanika gelombang; diprakarsai oleh 3 ahli :
a) Louis Victor de Broglie
Menyatakan bahwa materi mempunyai dualisme sifat yaitu sebagai materi dan sebagai gelombang.
b) Werner Heisenberg
Mengemukakan prinsip ketidakpastian untuk materi yang bersifat sebagai partikel dan gelombang.
c) Erwin Schrodinger (menyempurnakan model Atom Bohr)
Berhasil menyusun persamaan gelombang untuk elektron dengan menggunakan prinsip mekanika gelombang.
Teori tentang Model Atom Modern :
a) Atom terdiri dari inti atom yang mengandung proton dan neutron sedangkan elektron-elektron bergerak mengitari inti atom dan berada pada orbital-orbital tertentu yang membentuk kulit atom.
b) Orbital yaitu daerah 3 dimensi di sekitar inti dimana elektron dengan energi tertentu dapat ditemukan dengan kemungkinan terbesar.
c) Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.
Ø Orbital digambarkan sebagai awan elektron yaitu : bentuk-bentuk ruang dimana suatu elektron kemungkinan ditemukan.
Ø Semakin rapat awan elektron maka semakin besar kemungkinan elektron ditemukan dan sebaliknya.






Tidak ada komentar:
Posting Komentar