BAB 12
IKATAN HIDROGEN
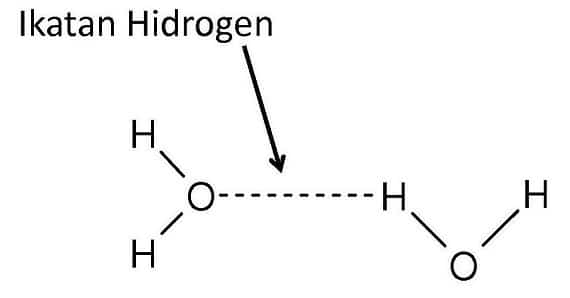
Ikatan Hidrogen
Dalam kimia, mempelajari fenomena ikatan hidrogen sangat penting karena dalam kita mendesain suatu reaksi kimia ataupun dalam menganalisis suatu proses kimia, ikatan hidrogen menjadi salah satu faktor penting yang harus diperhatikan.
Oleh karena itu, dalam artikel ini akan dibahas secara lengkap tentan ikatan hidrogen. Materi mengenai ikatan kimia seperti ikatan kovalen, ikatan ionik, dan ikatan logam dapat dipelajari lebih lengkap dalam materi Ikatan Kimia.
Pengertian Ikatan Hidrogen
Ikatan hidrogen adalah interaksi yang terjadi antara atom hidrogen yang terikat oleh atom dengan bilangan elektronegativitas yang tinggi dengan atom lain yang memiliki pasangan elektron bebas.
Ikatan hidrogen dapat terjadi karena ketika atom hidrogen mengikat atom lain dengan elektronegativitas tinggi seperti atom N, O, ataupun F, maka atom dengan elektronegativitas tinggi tersebut sesuai definisinya sebagai atom elektronegatif akan cenderung menarik elektron dari atom hidrogen yang digunakan secara bersama-sama ke arah atom tersebut.
Ketika hal itu terjadi, maka densitas elektron pada teori atom hidrogen cenderung sedikit dan berkurang sehingga atom hidrogen mengalami kekurangan elektron atau dapat dikatakan elektropositif. Kondisi tersebut membuat atom hidrogen tidak stabil sehingga hidrogen membutuhkan donor elektron dari atom lain.
Ketika atom hidrogen bertemu dengan atom lain yang memiliki pasangan elektron bebas seperti nitrogen ataupun oksigen, maka hidrogen yang kekurangan elektron akan mendekati pasangan elektron bebas dan mengadakan interaksi yang disebut dengan ikatan hidrogen. Hal itu dapat diilustrasikan pada gambar berikut.
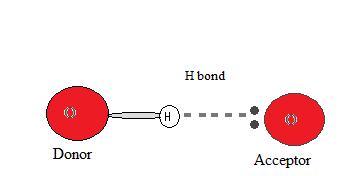
Dalam ilustrasi tersebut, atom donor merupakan atom dengan elektronegativitas tinggi sedangkan atom akseptor merupakan atom dengan pasangan elektron bebas.
Pada umumnya, ikatan hidrogen digambarkan tidak dengan garis yang tegas melainkan hanya dengan garis putus putus antara hidrogen dengan pasangan elektron bebas pada atom lain. Garis putus putus tersebut juga menunjukkan bahwa sebenarnya ikatan hidrogen tidak terjadi secara nyata, hanya berupa interaksi saja.
Perbedaan Ikatan Hidroen dan Ikatan Kovalen
Ikatan kovalen memiliki perbedaan yang cukup besar dengan ikatan hidrogen. Hal yang paling membedakan yaitu dari segi kekuatan ikatan dimana pada ikatan kovalen, dua atom yang saling berikatan memiliki kekuatan ikatan yang sangat tinggi sehingga membutuhkan energi yang tinggi untuk memecahkan ikatan tersebut.
Namun pada ikatan hidrogen, yang terjadi bukanlah ikatan asli melainkan hanya interaksi saja sehingga menyebabkan kekuatan ikatan antara hidroen dengan atom yang terikat secara ikatan hidrogen cenderung lebih lemah daripada ikatan kovalen, sehingga energi yang dibutuhkan untuk memecah ikatan hidrogen cenderung kecil.
Penyebabnya adalah pada ikatan kovalen terjadi serah terima elektron atau penggunaan elektron secara bersama sehingga ikatan yang dihasilkan kuat, sedangkan pada ikatan hidrogen tidak terjadi demikian melainkan hanya tarikan atau interaksi saja.
Hal itu juga berdampak pada jarak ikatan dimana pada ikatan kovalen umumnya memiliki jarak ikatan antar atom yang cenderung pendek karena kekuatan tarikan antar atom.
Sedangkan pada ikatan hidrogen, jarak antar atom yang berikatan cenderung lebih besar karena ikatan lemah yang terjadi sehingga daya tarik menariknya kurang.
Ciri-Ciri Ikatan Hidrogen
Dalam kimia, terdapat sejatinya banyak jenis ikatan kimia dimana hal itu didasarkan pada interaksi antara dua atom yang berikatan. Perbedaan karakteristik setiap ikatan seperti bagaimana cara distribusi elektron dalam suatu ikatan juga menentukan jenis ikatan yang dibentuk oleh suatu molekul. Untuk lebih lanjutnya berikut ini ciri ikatan yang terdapat dalam hidrogen, antara lain;
- Terjadi antara atom dengan pasangan elektron bebas dengan hidrogen yang terikat pada atom elektronegatif
- Kekutan ikatan cenderung lemah
- Panjang ikatan cenderung besar
- Pada alkana dengan rantai C yang sama, senyawa dengan ikatan hidrogen memiliki titik didih yang lebih tinggi
Akibat Adanya Ikatan Hidrogen
Meskipun kekuatan ikatan hidrogen cenderung kecil, namun adanya ikatan hidrogen memberikan dampak yang cukup besar pada beberapa makna sifat kimianya.
Titik didih air dan sifat kohesi
Air (H2O) merupakan salah satu senyawa kimia yang mengalai ikatan hidrogen secara intermolekuler atau dengan molekul air yang lain. Akibatnya, air memiliki titik didih yang tinggi yaitu 100C. Hal itu dikarenakan pada air yang kita gunakan setiap hari memiliki struktur dengan ikatan hidrogen setiap molekul air didalamnya, akibatnya ketika kita akan mendidihkan air maka diperlukan pemecahan untuk tiap ikatan hidrogen yang ada pada air tersebut.
Meskipun lemah, namun jumlah ikatan hidrogen yang sangat banyak membuat energi yang diperlukan untuk memecahnya menjadi tinggi. Energi yang tinggi bisa diperoleh dari suhu pemanasan yang juga tinggi sehingga air akan mendidih pada suhu 100C yang cenderung tinggi.
Selain itu, sifat kohesi atau gaya tarik menarik pada air juga disebabkan karena adanya ikatan hidrogen. Hal ini menyebabkan molekul air memiliki tegangan permukaan yang cukup besar dan akan membentuk bulat ketika diteteskan dari pipet.
Titik didih senyawa hidrokarbon
Pada senyawa berupa rantai hidrokarbon tanpa gugus –OH, pada umumnya memiliki titik didih yang rendah. Namun pada senyawa lain dengan jumlah rantai yang sama namun memiliki gugus –OH, cenderung akan memiliki titik didih yang lebih tinggi.
Contohnya yaitu pada senyawa hidrokarbon pentana dengan jumlah 5 atom C memiliki titik didih 36.1C, namun pada senyawa pentanol yang merupakan hidrokarbon dengan jumlah C yang sama yaitu 5 namun terdapat gugus –OH memiliki titik didih 138C.
Perbedaan yang sangat jauh antara kedua senyawa dengan jumlah atom C yang sama. Hal itu disebabkan karena pada pentanol yang memiliki gugus –OH dapat terjadi ikatan hidrogen pada atom O dan H sehingga memiliki kekuatan ikatan yang lebih besar daripada pentana yang tidak memiliki ikatan hidrogen.
Struktur DNA
DNA yang menyusun tubuh kita ternyata juga dipengaruhi oleh adanya ikatan hidrogen. Pada DNA terjadi ikatan hidrogen antar basa nitrogen sehingga terbentuk pasangan basa nitrogen, selain itu bentuk pilinan atau helix pada DNA juga disebabkan karena adanya ikatan hidrogen yang membuat struktur DNA menjadi tertekuk dan strukturnya melingkar. Tanpa adanya ikatan hidrogen, maka bentuk helix pada DNA tidak dapat terjadi.
Sifat Kelarutan
Jika kita berbicara tentang kimia maka tidak terlepas dengan larutan yang merupakan campuran antara zat terlarut dengan pelarut. Sifat kelarutan dari suatu zat dalam pelarut tertentu ternyata juga dipengaruhi oleh ikatan hidrogen.
Contohnya yaitu pada pelarut air yang mampu melarutkan berbagai molekul organik yang bersifat polar. Hal itu dikarenakan kemampuan membentuk ikatan hidrogen antara air dengan molekul polar atau sebaliknya. Namun ketika senyawa tersebut bersifat non-polar, maka air tidak mampu melarutkan senyawa tersebut karena tidak adanya ikatan hidrogen yang terbentuk.



Tidak ada komentar:
Posting Komentar